
SIND SIE ANGEHÖRIGER DER MEDIZINISCHEN FACHKREISE?
JA, ICH BIN ANGEHÖRIGER MEDIZINISCHER FACHKREISE*
TRETEN SIE EIN IN EINE WELT Langfristig GESTEIGERTER FAKTOR-IX-SPIEGEL2
HEMGENIX® (Etranacogen dezaparvovec) wurde entwickelt, um Patienten mit einer einzigen Infusion mehr Freiheit von den Belastungen durch die Krankheit zu ermöglichen. Die Zulassungsstudien belegen einen langfristig gesteigerten FIX-Spiegel von im Mittel 36,66% nach 24 Monaten. 96% der Teilnehmer konnten die Prophylaxe dauerhaft beenden.1,2,9

HEMGENIX® ist die erste und derzeit einzige in Europa zugelassene Gentherapie für die Behandlung der Hämophilie B.§ Sie setzt an deren Ursache an und kann die Einschränkungen der Patienten DURCH DIE HÄMOPHILIE B VERRINGERN.1,3,4
HEMGENIX® führt eine funktionelle Kopie des F9-Gens ein, um die bestehende F9-Mutation zu kompensieren. Diese innovative Gentherapie besteht aus einem nicht replizierenden, rekombinanten Adeno-assoziierten Virus vom Serotyp 5 (AAV5) als Vektor, der - unter der Kontrolle eines leberspezifischen Promotors - für die hochaktive Padua-Proteinvariante des Faktor-IX kodiert. Diese natürlich vorkommende Padua-Variante des FIX-Proteins hat eine 6- bis 8-fach höhere spezifische Aktivität als das häufigere Wildtyp-FIX-Enzym. Bei gleicher Dosis und Transduktionseffizienz lassen sich so höhere endogene FIX-Aktivitäten erzielen.5,6
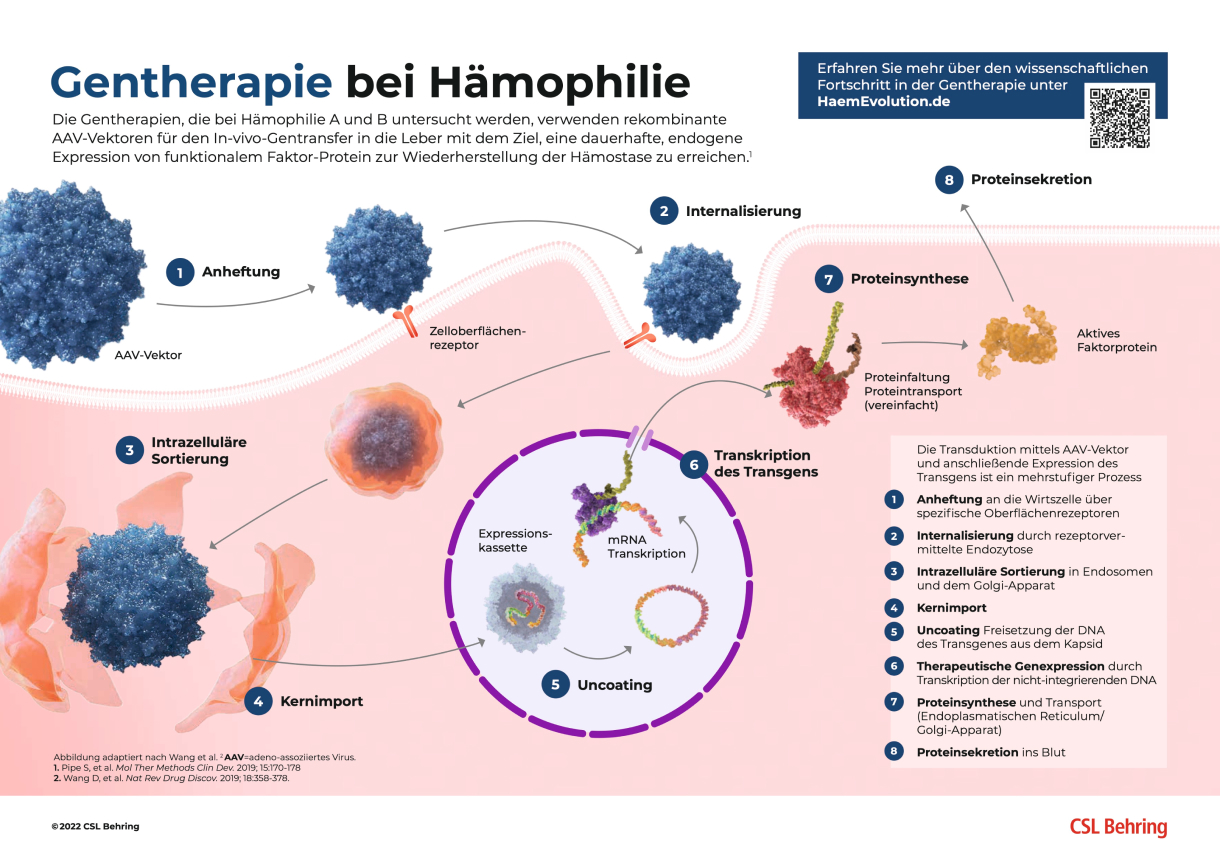
Der Wirkmechanismus der GENTHERAPIE für Hämophilie erklärt
Sowohl Hämophilie A wie auch Hämophilie B sind monogen, X-chromosomal, rezessiv-vererbte Krankheiten, die sich für eine Gentherapie eignen.2,7 Die Gentherapie der Hämophilie A bzw. B zielt darauf ab, die endogene Produktion und damit Konzentration des Gerinnungsfaktors-VIII bzw. -IX durch die Bereitstellung eines neuen funktionellen Gens bzw. einer kodierenden Sequenz zu erhöhen, um dadurch die klinischen Ergebnisse zu verbessern und den Bedarf einer Faktorprophylaxe zu verringern bzw. ganz zu beseitigen.2,3,8
Zurück
Patientenerfahrung
Weiter
Über HEMGENIX®
Referenzen
- EU Fachinformation HEMGENIX® (Europäische Arzneimittelagentur, 02/2023)
- Coppens M et al. Adults with haemophilia B receiving Etranacogene Dezaparvovec in the HOPE-B Phase 3 Trial experience a stable increase in mean Factor IX activity and durable haemostatic protection after 24 months’ follow-up. Vorgestellt: 16. Kongress der European Association for Haemophilia and Allied Disorders; Februar 2023; Manchester; Vereinigtes Königreich.
- Perrin GQ, Herzog RW, Markusic DM. Update on clinical gene therapy for Haemophilia. Blood. 2019;133: 407-414.
- CSL Behring. FDA Accepts CSL Behring’s Biologics License Application for Etranacogene Dezaparvovec for Priority Review. Press release. 24 May 2022. Available at: https://www.cslbehring.com/newsroom/2022/fda-bla-etranacogene-dezaparvovec. Letzter Zugriff Oktober 2022.
- Nathwani AC. Gene therapy for hemophilia. Hematology Am Soc Hematol Educ Program. 2019;2019(1):1-8.
- Thornburg CD. Etranacogene dezaparvovec for hemophilia B gene therapy. Ther Adv Rare Dis. 2021;2:1–14.
- Rodríguez-Merchán EC, et al. Gene Therapy in Hemophilia: Recent Advances. Int. J. Mol. Sci. 2021; 22: 7647-767.
- Miesbach W, et al. Gene therapy with adeno-associated virus vector 5–human factor IX in adults with hemophilia B. Blood. 2018; 131:1022-1031
- Pipe SW et al, Poster P0156 - Adults with haemophilia B receiving etranacogene dezaparvovec in the HOPE-B Phase 3 clinical trial experience a stable increase in mean factor IX activity and durable haemostatic protection after 24 months’ follow-up; 16. EAHAD-Kongress 8.-10. Februar 2023, Manchester, Vereinigtes Königreich.
§ Hemgenix ist indiziert zur Behandlung von schwerer und mittelschwerer Hämophilie B (angeborener Faktor-IX-Mangel) bei erwachsenen Patienten ohne Faktor-IX-Inhibitoren in ihrer Vorgeschichte.
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
HEMGENIX® 1 x 1013 Genomkopien/ml Konzentrat zur Herstellung einer Infusionslösung. Wirkst: Etranacogen dezaparvovec Zusammensetz: Ein Milliliter an Etranacogen dezaparvovec enthält 1 x 1013 Genomkopien (gk). Eine Durchstechflasche enthält ein extrahierbares Volumen von 10 ml Konzentrat zur Herstellung einer Infusionslösung mit insgesamt 1 x 10 14 Genomkopien. Die Gesamtzahl der Durchstechflaschen in jeder Packung entspricht dem Dosierungsbedarf für den betreffenden Patienten, abhängig vom Körpergewicht des Patienten. Sonst. Bestandteile: Dieses Arzneimittel enthält 35,2 mg Natrium pro Durchstechflasche (3,52 mg/ml), Saccharose, Polysorbat-20, Kaliumchlorid, Kaliumphosphat, Natriumchlorid, Natriumphosphat, Salzsäure (zur pH-Einstellung), Wasser für Injektionszwecke. Anw: Hemgenix ist indiziert zur Behandlung von schwerer und mittelschwerer Hämophilie B (angeborener Faktor-IX-Mangel) bei erwachsenen Patienten ohne Faktor-IX-Inhibitoren in ihrer Vorgeschichte. Gegenanz.: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile; Aktive Infektionen, sowohl akute wie unkontrollierte chronische; Patienten mit bekannter fortgeschrittener Leberfibrose oder -zirrhose. Nebenwirk: Aus klin. Studien Sehr häufig: Kopfschmerzen, Alanin-Aminotransferase erhöht, Aspartat-Aminotransferase erhöht, C-reaktives Protein erhöht, Grippeähnliche Erkrankung, Infusionsbedingte Reaktion (Überempfindlichkeit, Reaktion an der Infusionsstelle, Schwindelgefühl, Juckreiz am Auge, Hitzewallungen, Oberbauchschmerzen, Urtikaria, Beschwerden im Brustkorb, Pyrexie). Die Häufigkeit ergibt sich aus gepoolten infusionsbedingten Reaktionen mit ähnlichem Krankheitsbild. Einzelne Infusionsreaktionen traten bei 1 bis 2 Patienten mit ähnlicher Häufigkeit auf (Inzidenz 1,8 bis 3,5 %); häufig: Schwindelgefühl, Übelkeit, Müdigkeit, Unwohlsein, Kreatinphosphokinase im Blut erhöht, Bilirubin im Blut erhöht.
Weitere Hinweise siehe Fachinformation. Verschreibungspflichtig. Zulassungsinhaber: CSL Behring GmbH, Emil-von-Behring-Straße 76, D-35041 Marburg Stand: Dezember 2024.
Haben Sie eine Frage? Wir sind für Sie da.
Medizinische information: +49 69-305-84437
Vielen Dank für Ihre Anfrage, die wir in Kürze beantworten werden!